Д. И. Менделеева, естественная классификация химических
элементов, являющаяся табличным (или др. графическим) выражением периодического закона Менделеева (См.
Периодический закон Менделеева). П. с. э. разработана Д. И.
Менделеевым в 1869-1871.
История П. с. э. Попытки систематизации химических
элементов предпринимались различными учёными в Германии, Франции, Англии, США с 30-х годов 19 в. Предшественники Менделеева - И.
Дёберейнер, Ж.
Дюма, французский химик А. Шанкуртуа, англ. химики У. Одлинг, Дж. Ньюлендс и др. установили существование групп
элементов, сходных по химическим свойствам, так называемых "естественных групп" (например, "триады" Дёберейнера). Однако эти учёные не шли дальше установления частных закономерностей внутри групп. В 1864 Л.
Мейер на основании данных об атомных весах предложил таблицу, показывающую соотношение атомных весов для нескольких характерных групп
элементов. Теоретических сообщений из своей таблицы Мейер не сделал.
Прообразом научной П. с. э. явилась таблица "Опыт системы элементов, основанной на их атомном весе и химическом сходстве", составленная Менделеевым 1 марта 1869 (рис. 1). На протяжении последующих двух лет автор совершенствовал эту таблицу, ввёл представления о группах, рядах и периодах элементов; сделал попытку оценить ёмкость малых и больших периодов, содержащих, по его мнению, соответственно по 7 и 17 элементов. В 1870 он назвал свою систему естественной, а в 1871 - периодической. Уже тогда структура П. с. э. приобрела во многом современные очертания (рис. 2).
Чрезвычайно важным для эволюции П. с. э. оказалось введённое Менделеевым представление о месте элемента в системе; положение элемента определяется номерами периода и группы. Опираясь на это представление, Менделеев пришёл к выводу о необходимости изменения принятых тогда атомных весов некоторых
элементов (U, In, Ce и его аналогов), в чём состояло первое практическое применение П. с. э., а также впервые предсказал существование и основные свойства нескольких неизвестных
элементов, которым соответствовали незаполненные клетки П. с. э. Классическим примером является предсказание "экаалюминия" (будущего Ga, открытого П. Лекоком де Буабодраном (См.
Лекок де Буабодран) в 1875), "экабора" (Sc, открытого шведским учёным Л.
Нильсоном в 1879) и "экасилиция" (Ge, открытого немецким учёным К.
Винклером в 1886). Кроме того, Менделеев предсказал существование аналогов марганца (будущие Тс и Re), теллура (Po), иода (At), цезия (Fr), бария (Ra), тантала (Pa).
П. с. э. не сразу завоевала признание как фундаментальное научное обобщение; положение существенно изменилось лишь после открытия Ga, Sc, Ge и установления двухвалентности Be (он долгое время считался трёхвалентным). Тем не менее П. с. э. во многом представляла эмпирическое обобщение фактов, поскольку был неясен физический смысл периодического закона и отсутствовало объяснение причин периодического изменения свойств
элементов в зависимости от возрастания атомных весов. Поэтому вплоть до физического обоснования периодического закона и разработки теории П. с. э. многие факты не удавалось объяснить. Так, неожиданным явилось открытие в конце 19 в. инертных газов, которые, казалось, не находили места в П. с. э.; эта трудность была устранена благодаря включению в П. с. э. самостоятельной нулевой группы (впоследствии VIII
a-подгруппы). Открытие многих "радиоэлементов" в начале 20 в. привело к противоречию между необходимостью их размещения в П. с. э. и её структурой (для более чем 30 таких
элементов было 7 "вакантных" мест в шестом и седьмом периодах). Это противоречие было преодолено в результате открытия изотопов (См.
Изотопы). Наконец, величина атомного веса (атомной массы) как параметра, определяющего свойства
элементов, постепенно утрачивала своё значение.
Одна из главных причин невозможности объяснения физического смысла периодического закона и П. с. э. состояла в отсутствии теории строения атома (см.
Атом,
Атомная физика). Поэтому важнейшей вехой на пути развития П. с. э. явилась планетарная модель атома, предложенная Э.
Резерфордом (1911). На её основе голландский учёный А. ван ден Брук высказал предположение (1913), что порядковый номер элемента в П. с. э. (атомный номер Z) численно равен заряду ядра атома (в единицах элементарного заряда). Это было экспериментально подтверждено Г.
Мозли (1913-14, см.
Мозли закон). Так удалось установить, что периодичность изменения свойств
элементов зависит от атомного номера, а не от атомного веса. В результате на научной основе была определена нижняя граница П. с. э. (водород как
элемент с минимальным Z = 1); точно оценено число
элементов между водородом и ураном; установлено, что "пробелы" в П. с. э. соответствуют неизвестным элементам с Z = 43, 61, 72, 75, 85, 87.
Оставался, однако, неясным вопрос о точном числе редкоземельных элементов, и (что особенно важно) не были вскрыты причины периодического изменения свойств элементов в зависимости от Z. Эти причины были найдены в ходе дальнейшей разработки теории П. с. э. на основе квантовых представлений о строении атома (см. далее). Физическое обоснование периодического закона и открытие явления изотонии позволили научно определить понятие "атомная масса" ("атомный вес"). Прилагаемая периодическая система (см. илл.) содержит современные значения атомных масс элементов по углеродной шкале в соответствии с Международной таблицей 1973. В квадратных скобках приведены массовые числа наиболее долгоживущих изотопов радиоактивных элементов. Вместо массовых чисел наиболее устойчивых изотопов 99Tc, 226Ra, 231Pa и 237Np указаны атомные массы этих изотопов, принятые (1969) Международной комиссией по атомным весам.
Структура П. с. э. Современная (1975) П. с. э. охватывает 106 химических
элементов; из них все трансурановые (Z = 93-106), а также элементы с Z = 43 (Tc), 61 (Pm), 85 (At) и 87 (Fr) получены искусственно. За всю историю П. с. э. было предложено большое количество (нескольких сотен) вариантов её графического изображения, преимущественно в виде таблиц; известны изображения и в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (например, спирали) и т.д. Наибольшее распространение получили три формы П. с. э.: короткая, предложенная Менделеевым (
рис. 2) и получившая всеобщее признание (в современном виде она дана на
илл.); длинная (
рис. 3); лестничная (
рис. 4). Длинную форму также разрабатывал Менделеев, а в усовершенствованном виде она была предложена в 1905 А.
Вернером. Лестничная форма предложена английским учёным Т. Бейли (1882), датским учёным Ю. Томсеном (1895) и усовершенствована Н.
Бором (1921). Каждая из трёх форм имеет достоинства и недостатки. Фундаментальным принципом построения П. с. э. является разделение всех химических
элементов на группы и периоды. Каждая группа в свою очередь подразделяется на главную (а) и побочную (б) подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы
а- и
б-подгрупп в каждой группе, как правило, обнаруживают между собой определённое химическое сходство, главным образом в высших степенях окисления, которые, как правило, соответствуют номеру группы. Периодом называется совокупность
элементов, начинающаяся щелочным металлом и заканчивающаяся инертным газом (особый случай - первый период); каждый период содержит строго определённое число
элементов. П. с. э. состоит из 8 групп и 7 периодов (седьмой пока не завершен).
Специфика первого периода в том, что он содержит всего 2 элемента: H и He. Место H в системе неоднозначно: поскольку он проявляет свойства, общие со щелочными металлами и с галогенами, его помещают либо в Ia-, либо (предпочтительнее) в VIIa-подгруппу. Гелий - первый представитель VIIa-подгруппы (однако долгое время Не и все инертные газы объединяли в самостоятельную нулевую группу).
Второй период (Li - Ne) содержит 8 элементов. Он начинается щелочным металлом Li, единственная степень окисления которого равна I. Затем идёт Be - металл, степень окисления II. Металлический характер следующего элемента В выражен слабо (степень окисления III). Идущий за ним C - типичный неметалл, может быть как положительно, так и отрицательно четырёхвалентным. Последующие N, O, F и Ne - неметаллы, причём только у N высшая степень окисления V соответствует номеру группы; кислород лишь в редких случаях проявляет положительную валентность, а для F известна степень окисления VI. Завершает период инертный газ Ne.
Третий период (Na - Ar) также содержит 8
элементов, характер изменения свойств которых во многом аналогичен наблюдающемуся во втором периоде. Однако Mg, в отличие от Be, более металличен, равно как и Al по сравнению с В, хотя Al присуща
Амфотерность. Si, Р, S, Cl, Ar - типичные неметаллы, но все они (кроме Ar) проявляют высшие степени окисления, равные номеру группы. Таким образом, в обоих периодах по мере увеличения Z наблюдается ослабление металлического и усиление неметаллического характера
элементов. Менделеев называл элементы второго и третьего периодов (малых, по его терминологии) типическими. Существенно, что они принадлежат к числу наиболее распространённых в природе, а С, N и O являются наряду с H основными элементами органической материи (органогенами). Все элементы первых трёх периодов входят в подгруппы
а.
По современной терминологии (см. далее), элементы этих периодов относятся к
s-элементам (щелочные и щёлочноземельные металлы), составляющим I
a- и II
a-подгруппы (выделены на цветной таблице красным цветом), и
р-элементам (В - Ne, At - Ar), входящим в III
a - VIII
a-подгруппы (их символы выделены оранжевым цветом). Для
элементов малых периодов с возрастанием порядковых номеров сначала наблюдается уменьшение атомных радиусов (См.
Атомные радиусы), а затем, когда число электронов в наружной оболочке атома уже значительно возрастает, их взаимное отталкивание приводит к увеличению атомных радиусов. Очередной максимум достигается в начале следующего периода на щелочном элементе. Примерно такая же закономерность характерна для ионных радиусов.
Четвёртый период (K - Kr) содержит 18
элементов (первый большой период, по Менделееву). После щелочного металла K и щёлочноземельного Ca (s-элементы) следует ряд из десяти так называемых переходных
элементов (См.
Переходные элементы) (Sc - Zn), или
d-элементов (символы даны синим цветом), которые входят в подгруппы
б соответствующих групп П. с. э. Большинство переходных
элементов (все они металлы) проявляет высшие степени окисления, равные номеру группы. Исключение - триада Fe - Co - Ni, где два последних элемента максимально положительно трёхвалентны, а железо в определённых условиях известно в степени окисления VI. Элементы, начиная с Ga и кончая Kr (
р-элементы), принадлежат к подгруппам
а, и характер изменения их свойств такой же, как и в соответствующих интервалах Z у
элементов второго и третьего периодов. Установлено, что Kr способен образовывать химические соединения (главным образом с F), но степень окисления VIII для него неизвестна.
Пятый период (Rb - Xe) построен аналогично четвёртому; в нём также имеется вставка из 10 переходных элементов (Y - Cd), d-элементов. Специфические особенности периода: 1) в триаде Ru - Rh - Pd только рутений проявляет степень окисления VIII; 2) все элементы подгрупп а проявляют высшие степени окисления, равные номеру группы, включая и Xe; 3) у I отмечаются слабые металлические свойства. Таким образом, характер изменения свойств по мере увеличения Z у элементов четвёртого и пятого периодов более сложен, поскольку металлические свойства сохраняются в большом интервале порядковых номеров.
Шестой период (Cs - Rn) включает 32 элемента. В нём помимо 10
d-
элементов (La, Hf - Hg) содержится совокупность из 14
f-
элементов, лантаноидов (См.
Лантаноиды), от Ce до Lu (символы чёрного цвета). Элементы от La до Lu химически весьма сходны. В короткой форме П. с. э. лантаноиды включаются в клетку La (поскольку их преобладающая степень окисления III) и записываются отдельной строкой внизу таблицы. Этот приём несколько неудобен, поскольку 14
элементов оказываются как бы вне таблицы. Подобного недостатка лишены длинная и лестничная формы П. с. э., хорошо отражающие специфику лантаноидов на фоне целостной структуры П. с. э. Особенности периода: 1) в триаде Os - Ir - Pt только осмий проявляет степень окисления VIII; 2) At имеет более выраженный (по сравнению с 1) металлический характер; 3) Rn, по-видимому (его химия мало изучена), должен быть наиболее реакционноспособным из инертных газов.
Седьмой период, начинающийся с Fr (Z = 87), также должен содержать 32 элемента, из которых пока известно 20 (до элемента с Z = 106). Fr и Ra - элементы соответственно I
a- и II
a -подгрупп (s-элементы), Ac - аналог
элементов III
б -подгруппы (
d-
элемент). Следующие 14
элементов,
f-элементы (с Z от 90 до 103), составляют семейство актиноидов (См.
Актиноиды). В короткой форме П. с. э. они занимают клетку Ac и записываются отдельной строкой внизу таблицы, подобно лантаноидам, в отличие от которых характеризуются значительным разнообразием степеней окисления. В связи с этим в химическом отношении ряды лантаноидов и актиноидов обнаруживают заметные различия. Изучение химической природы
элементов с Z = 104 и Z = 105 показало, что эти элементы являются аналогами гафния и тантала соответственно, то есть
d-элементами, и должны размещаться в IV
б- и V
б-подгруппах. Членами
б-подгрупп должны быть и последующие элементы до Z = 112, а далее (Z = 113-118) появятся
р-элементы (III
a - VIll
a-подгруппы).
Теория П. с. э. В основе теории П. с. э. лежит представление о специфических закономерностях построения электронных оболочек (слоев, уровней) и подоболочек (оболочек, подуровней) в атомах по мере роста Z (см.
Атом,
Атомная физика). Это представление было развито Бором в 1913-21 с учётом характера изменения свойств химических
элементов в П. с. э. и результатов изучения их атомных спектров. Бор выявил три существенные особенности формирования электронных конфигураций атомов: 1) заполнение электронных оболочек (кроме оболочек, отвечающих значениям главного квантового числа (См.
Квантовые числа)
n = 1 и 2) происходит не монотонно до полной их ёмкости, а прерывается появлением совокупностей электронов, относящихся к оболочкам с большими значениями
n; 2) сходные типы электронных конфигураций атомов периодически повторяются; 3) границы периодов П. с. э. (за исключением первого и второго) не совпадают с границами последовательных электронных оболочек.
В обозначениях, принятых в атомной физике, реальная схема формирования электронных конфигураций атомов по мере роста Z может быть в общем виде записана следующим образом:
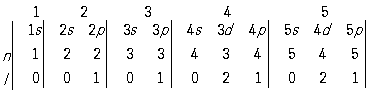
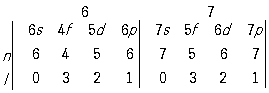
Вертикальными чертами разделены периоды П. с. э. (их номера обозначены цифрами наверху); жирным шрифтом выделены подоболочки, которыми завершается построение оболочек с данным
n. Под обозначениями подоболочек проставлены значения главного (
n) и орбитального (
l) квантовых чисел, характеризующие последовательно заполняющиеся подоболочки. В соответствии с
Паули принципом ёмкость каждой электронной оболочки равна
2n2, а ёмкость каждой подоболочки - 2(2
l + 1). Из вышеприведённой схемы легко определяются ёмкости последовательных периодов: 2, 8, 8, 18, 18, 32, 32... Каждый период начинается элементом, в атоме которого появляется электрон с новым значением
n. Таким образом, периоды можно характеризовать как совокупности
элементов, начинающиеся элементом со значением
n, равным номеру периода, и
l = 0 (
ns1-элементы), и завершающиеся элементом с тем же
n и
l = 1 (
np6-элементы); исключение - первый период, содержащий только
ls-элементы. При этом к
а-подгруппам принадлежат элементы, для атомов которых
n равно номеру периода, а
l = 0 или 1, то есть происходит построение электронной оболочки с данным
n. К
б-подгруппам принадлежат элементы, в атомах которых происходит достройка оболочек, остававшихся незавершёнными (в данном случае
n меньше номера периода, а
l = 2 или 3). Первый - третий периоды П. с. э. содержат только элементы
а-подгрупп.
Приведённая реальная схема формирования электронных конфигураций атомов не является безупречной, поскольку в ряде случаев чёткие границы между последовательно заполняющимися подоболочками нарушаются (например, после заполнения в атомах Cs и Ba 6
s-подоболочки в атоме лантана появляется не 4
f-, а 5
d-электрон, имеется 5
d-электрон в атоме Gd и т.д.). Кроме того, первоначально реальная схема не могла быть выведена из каких-либо фундаментальных физических представлений; такой вывод стал возможным благодаря применению квантовой механики (См.
Квантовая механика) к проблеме строения атома.
Типы конфигураций внешних электронных оболочек атомов (на илл. конфигурации указаны) определяют основные особенности химического поведения элементов. Эти особенности являются специфическими для элементов а-подгрупп (s-и р-элементы), б-подгрупп (d-элементы) и f-семейств (лантаноиды и актиноиды). Особый случай представляют собой элементы первого периода (H и He). Высокая химическая активность атомарного водорода объясняется лёгкостью отщепления единственного ls-электрона, тогда как конфигурация атома гелия (1s2) является весьма прочной, что обусловливает его химическую инертность.
Поскольку у элементов а-подгрупп происходит заполнение внешних электронных оболочек (с n, равным номеру периода), то свойства элементов заметно меняются по мере роста Z. Так, во втором периоде Li (конфигурация 2s1) - химически активный металл, легко теряющий валентный электрон, a Be (2s2) - также металл, но менее активный. Металлический характер следующего элемента B (2s2p) выражен слабо, а все последующие элементы второго периода, у которых происходит застройка 2р-подоболочки, являются уже неметаллами. Восьмиэлектронная конфигурация внешней электронной оболочки Ne (2s2p6) чрезвычайно прочна, поэтому неон - инертный газ. Аналогичный характер изменения свойств наблюдается у элементов третьего периода и у s-и р-элементов всех последующих периодов, однако ослабление прочности связи внешних электронов с ядром в а-подгруппах по мере роста Z определённым образом сказывается на их свойствах. Так, у s-элементов отмечается заметный рост химической активности, а у р-элементов - нарастание металлических свойств. В VIIIa-подгруппе ослабляется устойчивость конфигурации ns2np6, вследствие чего уже Kr (четвёртый период) приобретает способность вступать в химические соединения. Специфика р-элементов 4-6-го периодов связана также с тем, что они отделены от s-элементов совокупностями элементов, в атомах которых происходит застройка предшествующих электронных оболочек.
У переходных d-элементов б-подгрупп достраиваются незавершённые оболочки с n, на единицу меньшим номера периода. Конфигурация внешних оболочек у них, как правило, ns2. Поэтому все d-элементы являются металлами. Аналогичная структура внешней оболочки d-элементов в каждом периоде приводит к тому, что изменение свойств d-элементов по мере роста Z не является резким и чёткое различие обнаруживается лишь в высших степенях окисления, в которых d-элементы проявляют определённое сходство с р-элементами соответствующих групп П. с. э. Специфика элементов VIIIб-подгруппы объясняется тем, что их d-подоболочки близки к завершению, в связи с чем эти элементы не склонны (за исключением Ru и Os) проявлять высшие степени окисления. У элементов Iб-подгруппы (Cu, Ag, Au) d-подоболочка фактически оказывается завершенной, но ещё недостаточно стабилизированной, эти элементы проявляют и более высокие степени окисления (до III в случае Au).
В атомах лантаноидов и актиноидов происходит достройка ранее незавершённых f-подоболочек с n, на 2 единицы меньшим номера периода; конфигурация внешние оболочки сохраняется неизменной (ns2); f-электроны у лантаноидов не оказывают существенного влияния на химические свойства. Лантаноиды проявляют преимущественно степень окисления III (за счёт двух 6s-электронов и одного d-электрона, появляющегося в атоме La); однако такое объяснение не является достаточно удовлетворительным, так как 5d-электрон содержится только в атомах La, Ce, Gd и Lu; поэтому считается, что в др. случаях степень окисления III обусловлена переходом одного из 4f-электронов в 5d-подоболочку. Что касается актиноидов, то в интервале Z = 90-95 энергии связи электронов 6d и 5f оказываются весьма близкими, это объясняет способность элементов давать соединения в широком диапазоне степеней окисления - до VII у Np, Pu и Am. У актиноидов с Z ≥ 96 предпочтительной становится степень окисления III. Оценка химических свойств К и и элемента 105 позволяет считать, что в этой области П. с. э. начинается систематическое заполнение 6d-подоболочки.
Выше были в общих чертах объяснены причины и особенности периодического изменения свойств химических
элементов по мере роста Z. Это объяснение основано на анализе закономерностей реальной схемы формирования электронных конфигураций свободных атомов. Однако знание электронной конфигурации свободного атома часто не позволяет сделать однозначный вывод о важнейших химических свойствах, которые должен проявлять соответствующий
элемент. Например, внешние электронные конфигурации атомов He и щёлочноземельных металлов совпадают (
ns2), но "сходство" гелия с последними ограничивается лишь определённой аналогией в спектрах. Поэтому принцип периодического (по мере возрастания Z) повторения сходных типов электронных конфигураций лежит в основе периодической системы свободных атомов. Что касается П. с. э., то она отражает закономерное изменение свойств
элементов, проявляемых ими при химических взаимодействиях; в ходе последних происходит перестройка электронных конфигураций взаимодействующих атомов, иногда значительная. Поэтому между свободными и связанными атомами существует определённое различие. В целом же сходство электронных конфигураций свободных атомов коррелирует с подобием химического поведения соответствующих
элементов. Задача строгого количественного объяснения всей специфики проявляемых химическими элементами свойств и периодичности этих свойств оказывается чрезвычайно сложной, поэтому нельзя утверждать, что создана количественная теория П. с. э. Отдельные аспекты такой теории разрабатываются в русле современных методов квантовой механики (см.
Квантовая химия,
Валентность).
Верхняя граница П. с. э. пока неизвестна, поэтому неизвестно и конечное количество
элементов, охватываемых П. с. э. Вопрос о пределе искусственного синтеза
элементов также пока не решен. Все изотопы уже известных
элементов с Z ≥ 101 являются короткоживущими (см.
Ядерная химия). Однако существуют предположения, что ядра атомов гипотетических
элементов с Z = 114, 126, 164 и 184 будут достаточно устойчивы по отношению к спонтанному делению. Это даёт основания рассчитывать на осуществление синтеза таких
элементов. Оценка электронных конфигураций и важнейших свойств неизвестных
элементов седьмого периода показывает, что эти элементы, по-видимому, должны быть аналогами соответствующих
элементов шестого периода. Напротив, для восьмого периода (состоящего, согласно теории, из 50
элементов) предсказывается весьма сложный характер изменения химических свойств по мере роста Z, связанный с резким нарушением последовательности заполнения электронных подоболочек в атомах.
Значение П. с. э. П. с. э. сыграла и продолжает играть огромную роль в развитии естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, позволила дать современное определение понятия "химический элемент" и уточнить понятия о простых веществах и соединениях. Закономерности, вскрытые П. с. э., оказали существенное влияние на разработку теории строения атомов, способствовали объяснению явления изотонии. С П. с. э. связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и в предсказании новых особенностей химического поведения уже открытых элементов. П. с. э.- фундамент химии, в первую очередь неорганической; она существенно помогает решению задач синтеза веществ с заранее заданными свойствами, разработке новых материалов, в частности полупроводниковых, подбору специфических катализаторов для различных химических процессов и т.д. П. с. э.- также научная основа преподавания химии.
Лит.: Менделеев Д. И., Периодический закон. Основные статьи, М., 1958; Кедров Б. М., Три аспекта атомистики. ч. 3. Закон Менделеева, М., 1969; Рабинович Е., Тило Э., Периодическая система элементов. История и теория, М.- Л., 1933; Карапетьянц М. Х., Дракин С. И., Строение вещества, М., 1967; Астахов К. В., Современное состояние периодической системы Д. И. Менделеева, М., 1969; Кедров Б. М., Трифонов Д. Н., Закон периодичности и химические элементы. Открытия и хронология, М., 1969; Сто лет периодического закона химических элементов. Сборник статей, М., 1969; Сто лет периодического закона химических элементов. Доклады на пленарных заседаниях, М., 1971; Spronsen J. W. van, The periodic system of chemical elements. A history of the first hundred years, Amst.- L.- N. Y., 1969; Клечковский В. М., Распределение атомных электронов и правило последовательного заполнения (n + l)-групп, М., 1968; Трифонов Д. Н., О количественной интерпретации периодичности, М., 1971; Некрасов Б. В., Основы общей химии, т. 1-2, 3 изд., М., 1973; Кедров Б. М., Трифонов Д. Н., О современных проблемах периодической системы, М., 1974.
Д. Н. Трифонов.
Рис. 3. Длинная форма периодической системы элементов (современный вариант).
Рис. 4. Лестничная форма периодической системы элементов (по Н. Бору, 1921).
Рис. 2. "Естественная система элементов" Д. И. Менделеева (короткая форма), опубликованная во 2-й части 1-го издания Основ химии в 1871.
Периодическая система элементов Д. И. Менделеева.
Рис. 1. Таблица "Опыт системы элементов", основанной на их атомном весе и химическом сходстве, составленная Д. И. Менделеевым 1 марта 1869.


